 |
| Zurück |
Die Wirkung von Megamin® und Lycopenomin® auf die Zellen des Immunsystems
Nachweisliche Wirkungen von tribomechanisch aktivierten Zeolithen - TMAZ® (Megamin® versus Lycopenomin®) auf die Zellen des Blutbildes und auf die Zellen des Immunsystems von Patienten mit Immunmangelsyndromen u.a. Erkrankungen.Slavko Ivkovic FA f. Innere Medizin,
Angelika Silberbach FA f. Gynäkologie und Geburtshilfe,
Ulrich Deutsch FA f. Allgemeinemdizn,
Erwin Walraph FW f. ImmunologieEinleitung Megamin® und Lykopenomin® sind Mineralprodukte aus tribomechanisch aktivierten Felsenmineralien sog. Zeolithen (Klinoptilolith).
Zeolithe sind natürliche mikroporöse Silicat-Mineralien, die farblos bis weiß oder hellrot gefärbt sein können. Weitere Verfärbungen sind durch Verunreinigungen und/oder zusätzliche Mineralien möglich. In der chemischen Zusammensetzung handelt es sich um Al-Na-oder Al-Ca-Silicate, die beim Erhitzen aufschäumen und sich scheinbar zersetzen.
Ueki und Mitarbeiter [38] haben gezeigt, daß sich die Silica, Silicate und Aluminiumsilicate wie unspezifische Immunmodulatoren, ähnlich den Superantigenen (SAg) verhalten. Unter Superantigene versteht man Immunmodulatoren die ähnlich den krankheitsverursachenden Proteinen bakterieller oder viraler Herkunft die Fähigkeit besitzen, relativ große Teile (5-20%) der T-Zell-Population zu aktivieren. Es kommt zu Interaktionen von SAg mit den Vß Domainen und den T-Zell Rezeptoren. Zeolithe greifen somit in den Regulationsmechanismus der Zellen des Immunsystems ein. Weiterhin führen diverse Viruserkrankungen, z.B. Hepatitis, HIV, Herpes simplex u.a. auch zu einer Erhöhung des oxidativen Streß.
Pavelic und Mitarbeiter [39], berichteten unlängst, daß tribomechanisch aktivierte natürliche Zeolithe (Klinoptilolithe) auch unerwartet positive Auswirkungen bei der Behandlung von Autoimmunerkrankungen zeigten.
Es scheint, daß Mineralpartikel Alterationen auf Gene hervorrufen können, indem sie verstärkt Signale bei der Gentransaktivation initiieren [20]. Modifikationen der kinetischen Rezeptoraktivationen können für das beobachtete Verhalten verantwortlich gemacht werden. Alternativ stimulierten Partikel die Produktion der reaktiven oxygenen Verbindungen. Kürzlich wurde darüber hinaus gezeigt, daß ohne Zweifel die Regulation der Gene ein allgegenwärtiges Phänomen in den meisten Zellen ist. Egal ob die Stimulation bei der Rezeptor-Aktivation oder bei der Stimulierung der Produktion von reaktiven oxygenen Arten vorkommt. Es führt immer zu einer Aktivierung oder Deaktivierung von bestimmten Proteinkinasen und einigen Transkriptionsfaktoren [22]. Es wurde festgestellt, daß die Bloßstellung von Silikatpartikelzellen zu einer Aktivierung von Mitogen aktivierter Proteinkinase, Proteinkinase C und Streß aktivierter Proteinkinase (SAPK) [23] führt. Es werden auch weiterhin wichtige Transkriptionsfaktoren wie AP-1 (proapoptotischer Faktor -gen c-jun + protein c-Fos.) oder NF?B (necrosis factor − Protein 65 und Protein 50) aktiviert. Die zellulären Ausschüttungen von Entzündungszytokinen wie IL-1, IL-6 oder TNF wurden ebenfalls gesteigert [24].
Silikate als Superantigen induzieren in vitro polyclonale T-Zell-Aktivierungen in Humanzellen. Aus diesem Grunde besitzen Kieselerden und verwandte Substanzen wie Silikate "adjuvante Effekte" [38].
So hemmen Klinoptilolithe das Wachstum und damit die Überlebensschance von Salmonella trypanosoma im Boden. Es besteht eine positive Korrelation des Wassergehaltes zur Korngröße der Zeolithe [34].
Die bakteriziden Eigenschaften von Zeolithen wurden zur Verhinderung von Harnwegsinfektionen bei der Anwendung von Ballonkathetern ausgenutzt. Bei der Verwendung von Zeolithen konnten Harnwegsinfektionen weitgehend vermieden werden. Die mit Zeolithen behandelten Katheter zeigten einen bakteriziden Effekt auf Pseudomonas aeruginosa, Staphylococcus aureus und Escherichia coli [35].
Ag-Zeolithe (Zeonic) − ein neues antimikrobielles Material kombiniert mit einem kommerziellen Gewebespüler - zeigte einen starken antifungiziden Effekt. Das Produkt hemmt Candida albicans am Wachstum, an der Säureproduktion und es ist eine potentielle Hilfe bei der Plaque control [25]. Klinische Studien zeigten, daß Silber Zeolithe die Plaque Formationen reduzieren [24].
Materialien und Methoden: Megamin® und Lycopenomin®
Die nachweislichen Auswirkungen von Megamin® und Lycopenomin® (Grundsubstanz: TMAZ) auf die Blutzellen (Blutbild) und auf die Zellen des Immunsystems von vorwiegend Patienten mit Immunmangelsyndromen.
Megamin® und Lycopenomin® enthalten als Grundsubstanz natürliche TMAZ:
Chemische Zusammensetzung = Hydratisiertes − Aluminiumsilikat der Alkali und Erdalkali.
SiO2 65,0 − 71,3 %, Al2O3 11,5 − 13,1 %, CaO 2,7 − 5,2 %, K2O 2,2 − 3,4 %, Fe2O3 0,7 − 1,9 %, MgO 0,6 − 1,2 %, Na2O 0,2 − 1,3 %, TiO2 0,1 − 0,3 %, Si/Al −Verhältnis 4,8 − 5,4
Mineralogische Form = Klinoptilolith. Gerüstsilikat Chemische Art = Molekularsieb.
Empirische Formel = (Ca,K2,Na2,Mg)4Al8Si40O96 x24 H2O
Physikalisch − mechanische Daten: Spezifisches Gewicht − 2,2 − 2,5 g/cm3, Porosität: 32 − 40 %, effektiver Porendurchschnitt 0,4 nm (4 Angström).
Ionenaustauscheigenschaften: Totalaustausch Ca2+ 0,64 − 0,98 mol/kg,
Mg2+ 0,06 − 0,19 mol/kg , K+ 0,22 − 0,45 mol/kg , Na+ 0,01 − 0,19 mol/kg
Totale Austauschkapazität 1,2 − 1,5 mol/kg
Adsorptionssfähigkeit: Ammoniak NH3, Kohlenwasserstoffe C1 bis C4, Kohlendioxid CO2, Schwefelwasserstoff H2S, Schwefeldioxid SO2, Stickoxide NOX, Aldhyde
Toxizität: Nicht toxisch, europäische Zulassung als Lebensmittelzusatzstoff nach DIN 53 770, amerikanische Zulassung Code of Federal Regulations, Food and Drugs (FDA), 2 CFR CH. I, § 182 Subpart C .
Selektivität: Cs > NH4+ > Pb2+> K+>Na+ > Mg2+ > Ba2+ > Cu2+, Zn2+
(Auswertung durch ISEGA-Forschungs- und Untersuchungs-Gesellschaft mbH Aschaffenburg
Dr. Ralph Derra − Öffentlich bestellter und vereidigter Sachverständiger für Verpackungsmaterialien, Boden- und Luftanalysen)Durch die tribomechanische Aktivierung der Zeolithe (TMAZ) kommt es zur Aktivierung der Körnchenoberfläche und zur Veränderung der Struktur bei den Zeolithen. Die Verarbeitungsmethode wird grundsätzlich für die Herstellung der polarisierten Substanz verwendet. Während der Verarbeitung werden die Körnchen des Rohstoffes einer Vielzahl von Zusammenstößen und Reibungen in sehr kurzen Zeitintervallen (0,0001 − 0,001 sec.) ausgesetzt; dadurch entsteht eine bedeutende Veränderung ihrer Geometrie bzw. Form. Durch die relative Bewegung eines Körnchens über die Oberfläche eines anderen Körnchens wird die Struktur des Kristallgitters auf der Oberfläche zerstört und oder wirkungsvoll aufgerissen, dies führt zu dem Ergebnis, daß die physikalischen, physikalisch − chemischen und energetischen Eigenschaften des Materials verändert werden. Als eine Begleiterscheinung dieser Verarbeitungsweise, wird das Material gleichzeitig zerkleinert und mikronisiert, es entstehen viele Körnchen im Mikronbereich 1,5 bis 4,0 µm.
Untersuchungsmethoden und Patienten:
Patienten: 31 Patienten mit nachgewiesener Immunschwäche erhielten das Nahrungsergänzungsmittel Megamin® (Klinoptilolith, Ca, Mg) für 37 Tage in einer Menge von 3 x 4 Kapseln / Tag. Von den 31 Patienten hatten 26 Patienten ein Immunmangel-Syndrom (IMS), bei 3 Patienten bestand ein Zustand nach einer Tumorbehandlung, 1 Patient hatte eine Furunkelose, 1 Patient hatte eine Typ-I-Allergie
30 Patienten erhielten das Nahrungsergänzungsmittel Lycopenomin aktivâ (ein Gemisch von stabilisiertem Klinoptilolith, OPC aus Traubenkernen, Lykopin aus Tomaten, Tomatenpulver und Vitamin C) für 37 Tage 3 x 2 Kapseln / Tag. Von den 30 Patienten hatten 18 Patienten ein IMS, bei 7 Patienten bestand ein IMS nach Tumortherapie, 3 Patienten hatten eine Typ-I- Allergie, bei 1 Patienten bestand eine Virusinfektion, bei 1 Patient bestand eine Rheumatiode Arthritis.
Das Alter der 61 Patienten betrug durchschnittlich 58 Jahre bei einer Standardabweichung von 14 Jahren. Der Anteil der Frauen betrug 74 %, der Anteil der Männer betrug 26 %.
Die Gesamtstudiendauer betrug durchschnittlich 53 Tage bei einer Standardabweichung von 13 Tagen. 65 Patienten wurden von Ärzten und vom Immunlabor ausgewählt und beraten. 61 Patienten beendeten die Megamin®- bzw. Lycopenomin®-Kur, 4 Patienten brachen die Behandlung ab und kamen nicht in die Wertung.
Bestimmungsmethoden:
Die Bestimmung des Blutbildes und die Typisierung der Lymphozyten erfolgten aus EDTA Blut vor und nach der Substitution der Nahrungsergänzungsmittel Megamin® und Lycopenomin® aktiv.
Die Veränderungen der Blutbildwerte und der Lymphozytendifferenzierung wurden erfaßt und mathematisch ausgewertet. Explorativ berechnete statistische Significanzen werden mittels sogenannter p-Werte gekennzeichnet. Die folgende Tabelle zeigt einen Bewertungsmaßstab für die p-Werte.Tabelle 2: Kennzeichnung der explorativen Signifikanzen
Symbol Irrtumswahr-
scheinlichkeitBedeutung n.s. p>0.05 nonsignifikanter Unterschied zwischen Gruppen oder zwischen
Meßzeitpunkten* p£0.05 explorativ signifikanter Unterschied oder zwischen Meßzeitpunkten
Materialien/Geräte:
Die Bestimmung des Blutbildes (Hb in mmol/l / HK / Leukozyten WBC in Gpt/l,Thrombozyten PLT in Gpt/l / Erythozyten RBC in Tpt/l ,MCH in fmol/l / MCHC in mmol/l / MCV in fl, Lymphozyten / Monozyten / Granulozyten in Zellen / µl) erfolgte am Blutbildautomaten der Fa. Sysmex. Die Lymphozytendifferenzierung (jeweils 15.000 Zellen pro monoklonalem Antikörper) wurde mit Hilfe der Durchflusszytometrie "FACScan" der Fa. Becton-Dickinson vorgenommen. Zum Einsatz gelangten die monoklonalen Antikörper des Simultest der Firma Beckmann - Coulter mit verschiedenen monokl. Antikörpern (mAk). Bestimmt wurden: Lymphozyten Zellzahl/µl, Monozyten Zellzahl/µl, Granulozyten Zellen/µl; prozentualer und absoluter Anteil der CD3+Lymphozyten (reife T-Lymphozyten), CD19+B-Lymphozyten, CD3+/CD4+ Lymphozyten (T-Helfer-Zellen), CD3+/CD8+Lymphozyten (T-Suppressor-Zellen), CD3/Aktiv.HLA-DR-T-Lymphozyten, CD56+Lymphozyten (NK-Zellen) und Ermittlung des CD4/CD8-Quotienten. Die Ergebnisse vor und nach der Einnahme der Produkte wurden erfaßt und durch das Fachinstitut fuer Statistik in Wuerzburg mathematisch ausgewertet.Ergebnisse
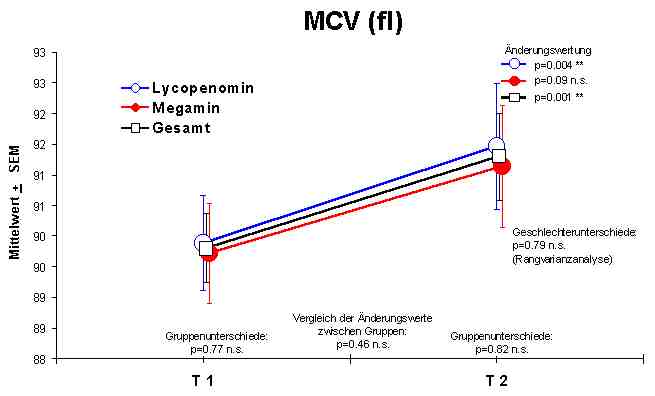
Änderungen im Blutbild: Es konnten sowohl bei der Anwendung von Megamin als auch bei Lycopenomin keine signifikanten Veränderungen in der Hämoglobin-Konzentration, im Hämatokrit, in der Anzahl der Thrombozyten, der Erythrozyten, der Lymphozyten und dem mittleren korpuskulären Hämoglobin (MCH) nachgewiesen werden. Die mittlere korpuskuläre Hämoglobinkonzentration (MCHC Normalwert 20,0 - 22,5 mmol/l) und das mittlere korpuskuläre Erythrozytenvolumen (MCV Normalwert 85 - 95 fl) zeigten eine signifikante Normalisierungen bzw. einen Anstieg. Die Zahl der Leukozyten (WBC 4,0 - 10,0 Gpt/l) zeigte eine leichte Verminderung, doch weitgehend im Normbereich.Abbildung 1
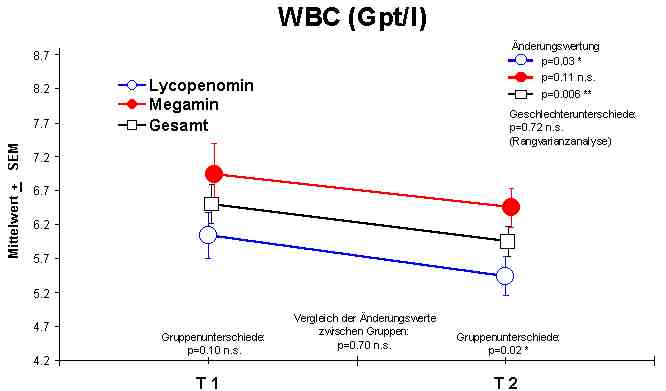
Abbildung 2
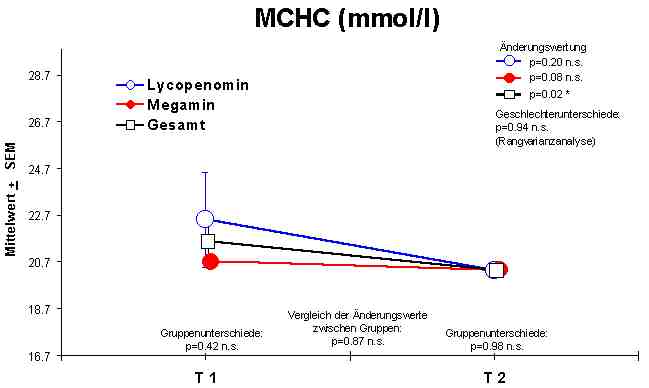
Abbildung 3
Änderungen der immunologischen Parameter:
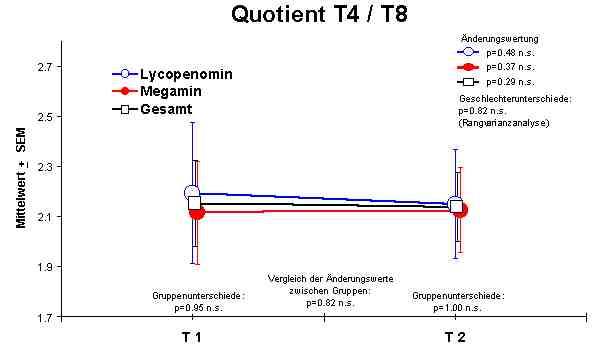
Sowohl Megamin® als auch Lycopenomin® (letzteres vermindert) zeigten einen jeweiligen signifikanten Anstieg bzw. Normalisierung fast aller immunkompetenten Zellen (ausser CD8-Lymphozyten).Abbildung 4
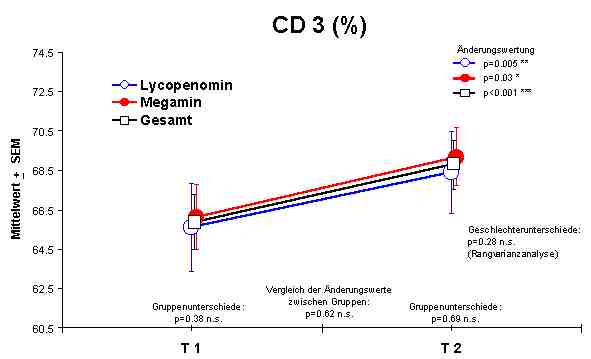
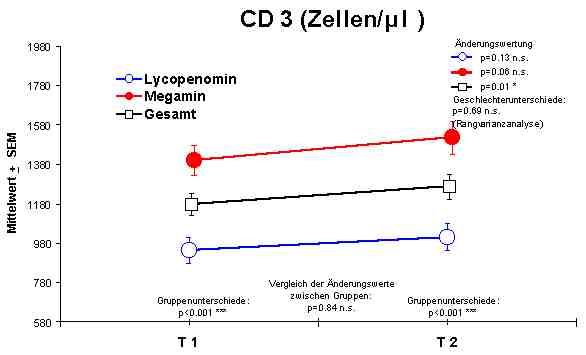
Abbildung 5
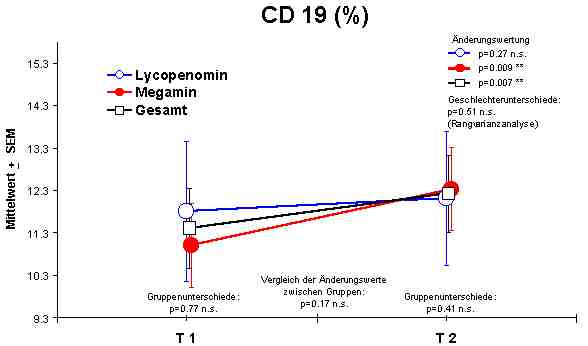
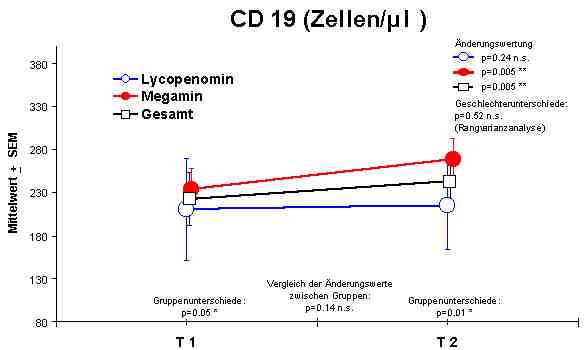
Abbildung 6
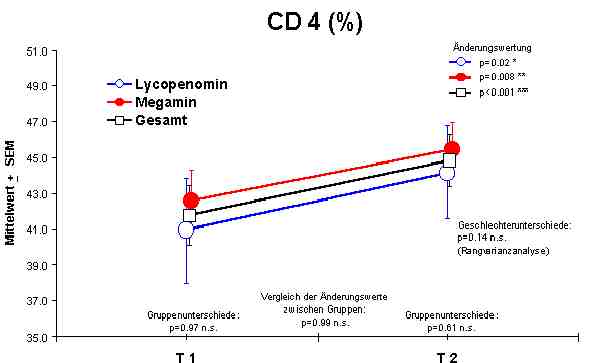
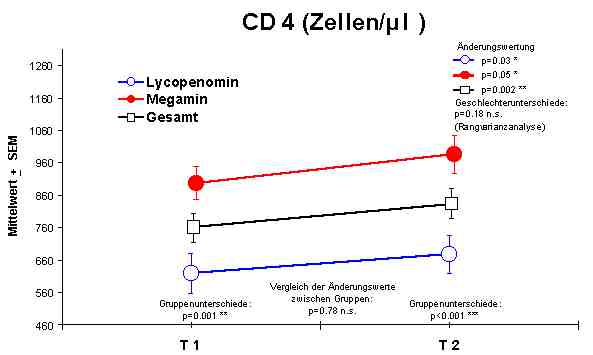
Abbildung 7
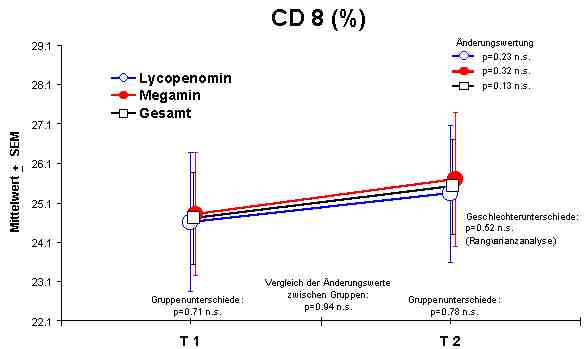
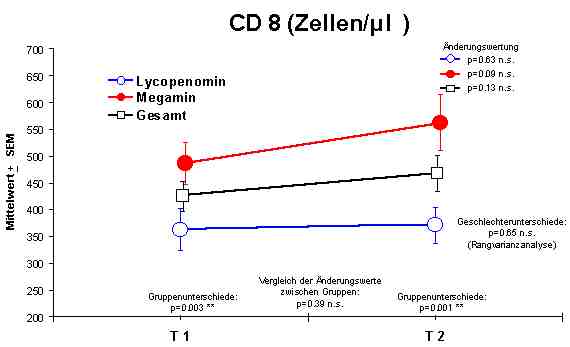
Abbildung 8
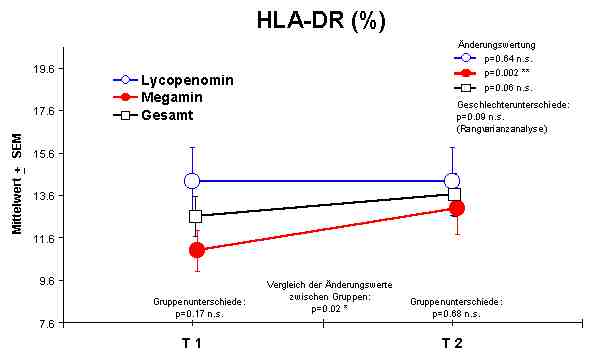
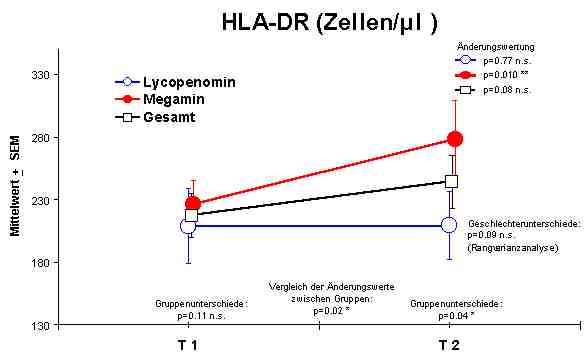
Abbildung 9
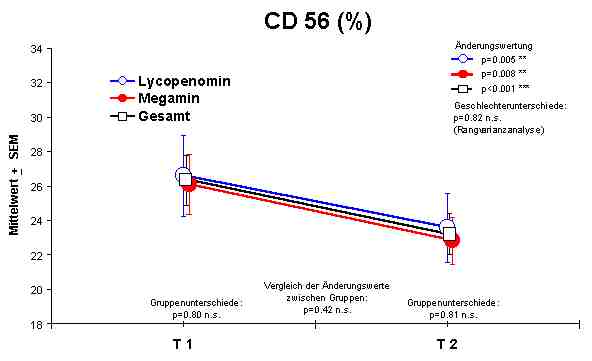
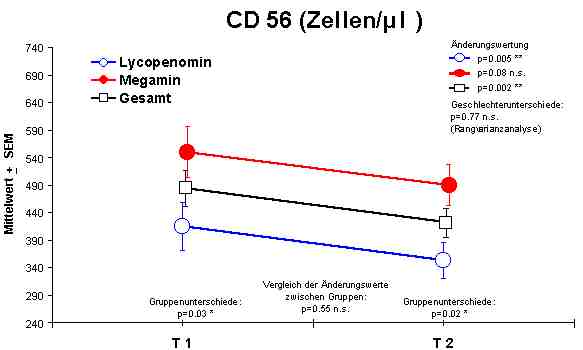
Abbildung 10
Diskussion:
Die Ergebnisse der statistischen Analytik ergaben folgende Übersicht:
Keine signifikanten Veränderungen der Hämoglobinkonzentration, des Hämatokrits, der Erythrozytenzahl, der Thrombozytenzahl und des MCH.
Signifikante Veränderungen im Blutbild wurden in der Leukozytenzahl in Richtung Normalisierung, MCHC in Richtung Normalisierung und dem MCV in Richtung Vergrößerung nachgewiesen.
Eine eindeutige Aussage über die Einflußnahme der o.g. Präparate konnte über das Blutbild nicht gewonnen werden.
Das Blutbild ist nicht zur Therapiekontrolle geeignet.
Anders ist die Einflußnahme der Präparate auf die Zellen des Immunsystems. In der Lymphozytendifferenzierung können folgende signifikante Veränderungen nachgewiesen werden:
CD3 + Lymphozyten - AnstiegDie Anzahl der NK-Zellen gibt keine Aussage über die Aktivität der Zellen. Wenn aber eine Normalisierung der Gesamtzahl dieser Zellen erreicht wird, muß davon ausgegangen werde, dass eine Beeinflussung der Aktiviät der NK-Zellen zu Gunsten der Aktivität erfolgt.
CD19 + Lymphozyten - Anstieg
CD4 + Lymphozyten - Anstieg
CD8 + Lymphozyten - keine Veränderung
Ratio - keine Veränderungen
HLA-DR + Lymphozyten - nur Anstieg durch Megamin®
CD56 + Lymphozyten - Reduktion in Richtung zur Normalisierung.
Die Lymphozytendifferenzierung vor, während und nach der Therapie mit o. g. Präparaten ist zur Therapiekontrolle geeignet. Die geringsten Veränderungen sind in der Suppressor-Zellpopulation erkennbar, sehr wahrscheinlich ist die Zeit der Behandlung von 37 Tagen zu gering, da vielfach die CD8-Lymphozyten bei einem bestehenden Immunmangelsyndrom am stärksten betroffen sind. Die Ratio von CD4/ CD8-Zellen zeigt keine signifikanten Veränderungen und kann nicht als Therapiekontrolle verwendet werden. Der Wirkungseffekt auf die immunkompetenten Zellen durch Megamin® ist größer als durch Lycopenomin®. Die Ursache ist darin zu sehen, daß der Zelolitheanteil in Megamin® bei einer Substitution von 3 x 4 Kapseln/Tag höher liegt als beim Lycopenomin® mit 3 x 2 Kapseln/ Tag. Die jeweiligen Wirkungssubstanzen OPC und Lycopin duerften ebenfalls unzureichend sein. Um den Effekt einer Immunmodulation zu erreichen, sind auch bei der Anwendung von Lycopenomin® höhere Tageskonzentrationen anzusetzen.
Während synthetische Medikamente im allgemeinen die Wirkung und Bildung von Antikörpern hervorrufen, wird TMAZ (tribomechanisch aktivierte Zeolithe) im Körper so tolerant wie die Nahrung aufgenommen. Einige Fragen, z.B. wie erfolgt die Aufnahme durch die Darmwand und wie erfolgt die direkte Einwirkung auf die Lymphozyten müssen geklärt werden. Der Mechanismus der Aufnahme von oral angewendeten Zeolithen müsste durch eine enge Zusammenarbeit von Medizinern, Chemikern und Physikern geklärt werden. Zuerst wurden physikalisch- chemische Analysen von TMAZ durchgeführt. Die Ergebnisse dieser Analysen zeigten, dass aktivierte Zeolithe die gleichen kristallinen Strukturen, chemischen Zusammensetzungen, Teilchenstrukturen, Oberflächenchemie und katalytische Aktivitäten wie das unbehandelte Probematerial aufwiesen. Der einzige Unterschied zwischen diesen beiden Proben bestand in der mittleren Teilchengröße. Der aktivierte Zeolith zeigte einen großen Anteil an Teilchen (98 %) mit einem Durchmesser unter 1,5 - 4,0 µm. Die Teilchen hatten außerdem eine unregelmäßig rauhe Oberfläche. Biochemische Analysen zeigten, dass die Teilchen nicht in signifikanten Konzentrationen in den menschlichen Körper eindringen, sich aber in lipiden Liposomen und Modellmembransystemen inkorporieren lassen. Dies läßt vermuten, dass eine indirekten Wirkung durch die Modifizierung auf die Zellen des Immunsystems über die GALT besteht. Es ist bekannt, dass Teilchen, kleiner als 1,5 bis 4,0 µm in das Darmgewebe eindringen und Kontakt mit dem gastrointestinal-assoziertem Immunsystem (GALT) aufnehmen. Die Lymphozyten treffen dort auf zahlreiche Antigene. Es ist erforderlich, dass das GALT nicht mit Nahrungsbestandteilen reagiert. Deswegen verhält sich jedes Antigen das eine Beziehung zum GALT aufnimmt tolerant. Ist das nicht dar Fall, kommt es zu Nahrungsmittel- Unverträglichkeiten. Wenn man zum Beispiel diabetischen Mäusen Insulin verfüttert, beschleunigt dies den Verlauf der Krankheit. Füttert man arthritischen Mäusen Kollagen 2, verstärkt dies ebenfalls die Arthritis.
Wie kann ein Präparat die Immunreaktionen in einem Fall verbessern und im anderen Fall aktivieren? Diverse durchgesehene Literatur zeigte, dass es Antigene gibt, die so widersprüchliche Reaktionen des Immunsystems hervorrufen. Solche Antigene bezeichnet man als Superantigene.
Superantigene (SAg) sind eine Gruppe von Immunmodulatoren und Krankheiten verursachende Proteine bakteriellen oder viralen Ursprungs mit der Eigenschaft, große Teile der T-Zell- Population (5-20%) zu stimulieren bzw. zu aktivieren. Die Aktivierung erfordert eine gleichzeitige Interaktion der SAg mit der Vß Domäne des T-Zellrezeptors (TCR) und mit dem wichtigsten Histokompatibilitätskomplex (MHC) der Klasse II Molekülen auf der Oberfläche der antigen präsentierenden Zelle (APC). Neueste Erkenntnisse der Strukturen solcher Komplexe zeigen, dass Superantigene die normale Aktivierung der T-Zellen durch physikalische Bindung von TCR und APC übertreffen. Dies führt zuerst zu einer starken Immunreaktion mit darauffolgendem Reaktionsverlust und dem Absterben von T Zellen. Zahlreiche klinische Versuche werden derzeit durchgeführt, um die Effizienz der genetisch angelegten schwächeren Formen der SAg zur Behandlung von Autoimmunerkrankungen, Infektionskrankheiten und Tumore zu testen. Bei Autoimmunaggressionen tötet eine solche Behandlung viele Th1- und CD4-Lymphozyten. Weniger aktive Th2 und eventuell Th3-Zellen überwiegen sodann. Solche Zellen sondern immunsuppressive Cytokine TGF-beta (Transforming-Growth-Factor-Beta-Receptor- Transformierter Wachstumsfaktor) , IL 10 aus und unterdrücken die selbstzerstörerischen Aktivitäten des Immunsystems.Eine gute Übersichtsarbeit über den Mechanismus der SAg-Aktion legten H.Li et al.; ANN.REV. Imunol Vol: 17, S.435 -466 (1999) vor.
Diese Zusammenhänge erklären die Wirkung von TMAZ bei Autoimmunkrankheiten.
Bei Tumore wäre es kontraproduktiv Th1-Zellen zu reduzieren. Das Absterben von Th1-Zellen verursacht bei Krebspatienten eine Aktivierung der natürlicher Killerzellen und durch NK-Zellen aktivierte Th1- Zellen.
Solche Zellen sind bei der Bekämpfung von Krebs deutlich effektiver. Superantigene sind z.B. auch Aluminiumsilikate (Übersicht in "Immunology", Vol. 82(2); pp.332-335 (1994) and International Journal of Oncology, Vol. 12(6); pp 1355-1359 (1998).
In diesem Zusammenhang können wir feststellen, dass TMAZ auf das Immunsystem wie ein SAg wirkt. Die andere Art der Immunzellen, die B-Zellen, können ebenfalls durch SAg aktiviert aber auch deaktiviert werden. Dies Art von Zellen die auf Superantigene reagieren sind die sog. CD5+ B-Zellen. Pavelic und Mitarbeiter haben gezeigt, das solche Zellen in Ratten aktiviert wurden. Um Immunreaktionen bei Autoimmunkrankheiten bekämpfen zu können, sollte TMAZ in der Lage sein den Zelltod (Apoptosis) auslösen zu können. Viele verschiedene Zellen in Zellkulturen wurden abgetötet, sobald sie mit TMAZ in Kontakt kamen. Gleichzeitig verursachte TMAZ auch einen Wachstumsstop. Dieser Wirkungsmechanismus wurde untersucht. TMAZ inhibierte die antiapoptotische Proteinkinase B/akt. In einigen Fällen wurden auch die Moleküle zur Unterdrückung eines Tumors p21 und p27 induziert. Dies könnte wahrscheinlich auch die JNK-1 Kinase (c-Jun N-terminal Kinase.oder SAPK stress-ectiveted protein kinase) deaktivieren, die benötigt wird, um hochzerstörerische Th1-Zellen zu aktivieren. Weitere Forschungen in diesem Bereich sind notwendig. Tierversuche mit diabetischen und krebsinfizierten Mäusen und andere Krankheitsmodelle werden derzeit durchgeführt. Abschließend sind wir der Meinung, dass oral angewendetes TMAZ in das GALT eindringt wo es zur direkten Beeinflussung und zur Modifizierung des Immunsystems kommt. Wichtig ist dabei die orale Toleranz, da TMAZ vermutlich ein Superantigen ist, verringert es die Antwort des Immunsystems gegenüber diversen Antigenen und ist daher hilfreich bei der Behandlung vieler Autoimmunerkrankungen und Überempfindlichkeitsreaktionen. Eine derartige Deaktivierung einiger Immunzellen könnte andere aktivieren, was wiederum die Wirkung von TMAZ gegen einige Krebsarten auslösen könnte. Der gleiche Mechanismus könnte hilfreich bei der Aktivierung von Immunreaktionen auf bestimmte Erkrankungen wie z.B. Virusinfektionen sein.Zusammenfassung:
Der therapeutische Einsatz von Megamin® und Lycopenomin® belegte, daß in sehr kurzer Zeit eine Immunmodulation der B-Lymphozyten, T-Lymphozyten und NK-Zellen erreicht werden kann. Da bei sehr vielen Erkrankungen, insbesondere bei den Erkrankungen des Immunsystems eine spezifische Einwirkungen auf die Pathogenese der Krankheiten ausgeübt werden kann, ist die Anwendung dieser Produkte besonders auf Grund der natürlichen Struktur und des Aufbaus von außerordentlichem Wert. Aus diesem Grunde sind die Therapieeffekte auf verschiedene Erkrankungen erklärbar. Es können mit Hilfe der Produkte Megamin® und Lycopenomin® Präparates Zeolithe folgende Erkrankungen über den komplexen Weg der Immunmodulation behandelt werde:
Primäre und sekundäre ImmundefizienzenSofern bestimmte Zellen des Immunsystems mit Hilfe der o.g. Produkte erreicht werden, erfolgt durch die Interaktion aller Anteile des gesamten Immunsystems die Abwehr und die Modulation der körpereigenen und der körperfremden Antigene. Mit Hilfe der Immunität werden sie erfaßt und können eliminiert werden. Die Aufgaben des Immunsystems, den menschlichen Organismus vor Veränderungen und Erkrankungen zu schützen und zu bewahren, werden wahrscheinlich hervorragend gelöst, zumal insbesondere keine toxischen Reaktionen bisher bekannt geworden sind.
Autoimmunerkrankungen
Ueberempfindlichkeitsreaktionen
Immunkomplexerkrankungen
Neoplasien
maligne Erkrankungen des Immunsystems
Neuroimmunologische und psychiatrische Syndrome
Literaturverzeichnis
1. Townsend RP: Einführung in die Wissenschaft und Anwendung von Zeolithen. Elsewier Amsterdam, p359, 1991.
2. Mumpton FA: La roca magica: Gebrauch der natürlichen Zeolithe in Landwirtschaft und Industrie. Proc. Natl. Acad. Sci. USA 96: 3463-3470, 1999.
3. Mitchell PCH: Zeolithe - eingekapselte Metall Komplexe: Biomimetische Katalysatoren. Chemische Industrie. & Mai 308-311, 1991.
4. Thomas JM, Catlow CRA: Neüs Licht auf der Struktur von aluminosilik. Katalysatoren. Progr. Inorg. Chem. 35:1-49, 1988.
5. Diegruber H, Plath PJ, Schulz-Ekloff G: Studie betreffend der Struktur, der Stabilität und der Propen-Oxidations-Möglichkeit von Komplexen. J.Molecular Catl. 24: 115 - 126, 1984.
6. Cattaneo MV, Chang TM: Das Potential eines microeingekapselte Urease - Zeolit Sorbent für die Beseitigung des Harnstoffs und Uremie. ASAIO Trans 37.80-87, 1991.
7. Herron N: Zeolithe Katalysatoren als Enzymnachahmungen.
8. Mizik P, Hrusovsky jJ, Tokosova M: Der Effekt von natürlichen Zeolithen .Vet. Med 34:467-474, 1989.
9. Valcke E, VidalM, Cremers A, Ivanov J, Perepelyatnikov G: Der Gebrauch von Zeolithen.
10. 18.218-224,1997.
11. Grant DC, Skirba MC, Saha AK. Umwelt. 6 :104-109.1987.
12. Pansini M, Colella C, De`Gennaro M: Chrombeseitigung von Wasser bei Ionenaustausch beim Gebrauch von Zeolithen. Entsalzung 83: 145-157,1991.
13. Passaglia E, Vezzalini G: Constr.Mineral. Petrol, 90:129. 1985.
14. Haidonti C. Inaktivation von beim Gebrauch von natürlichen Zeolithen von Quecksilber in der verunreinigten Erdreichbenützung. 208: 105-109, 1997.
15. Capiaumont J, Legrand C, Carbonell D, Dousset B, Belleville F, Nabet D.: Methoden für die Reduktion von Amoniak bei Zellkulturen.
16. J. Biotechnology 39:49-58,1995.
17. Seidel H, Bartko P, Kovac G, Paulikova I, Nagy O: Wirkungen von Haemoperfusion Acta Veterinaria Brno 66:213-218,1997.
18. Patzer JD, Shang JY, Wolfson SK: Zeolitischer Ammoniumaustausch für tragbare Hemodialyse. Regeneration. ASAIO J., 41: 221-226,1995.
19. Concepcion - Rosabal B., Rodrigüz - Fuentes G: Entwicklung des zeolitischen aktiven Prinzipes F2. 19:47-50, 1997.
20. Oschilewski V, Kiesel V, Kolb H. Verwaltung von Silizienpartikeln . Diabetes. 37: 197-199, 1985.
21. Charlton B, Bacelj A, Mandel TE: Verwaltung von Silicien Partikeln...Diabetes. 37: 930-935, 1988.
22. Morishita M, Miyagi M, Yasamaki Diabetes. 37: 197-199, 1985.
23. Charlton B, Bacelj A, Mandel TE: Verwaltung von Silicien Partikeln...Diabetes. 37: 930-935, 1988.
24. Morishita M, Miyagi M, Yasamaki , Tsuruda K: Pilotstudie. 9:94-96,1998.
25. Nikawa H, Yamamato T, Hamada T, Rahardjo MB: Antifungal Effekt von Zeolithen. J.Oral. Rehab. 24:350-357, 1997.
26. Rubin DL, Falk KL: Klinischer Versuch. 7:865-872, 1997.
27. Young SW, Quing F: Gadoliniium Zeolithe. J. Magn. Reson. Imaging 5:499-508,1995.
28. Mojzis J, Nisitar F, Kovac G, Mojzisova G: Vorsorgende Effekte von Zeolithen.Veterinarni Medicina. 39: 443-449, 1994.
29. Rodrigues-Fuentes G, Barrios MA, Iraizos A, Perdomo I, Cedre B: Anti-diarrheic Drogen basierend auf einem natürlichen Zeolit. 19:441-448, 1997.
30. Momcilovic B: Megamin, Glaube, Hoffnungen und Placebo, ein kritischer Rückblick. Art. Hig. Rada Toksikol. 50:67-78.
31. Lam A: Theoretische Studie der physikalischen Adsorbtion von Aspirin und natürlichen Klinoptoliten. Microporous Mesoporus Mater. 23 : 247-252,1998.
32. Ryn E, Shaey KC : Immunisierung von Hasen mit Zeolithen. Int.J. Zoonoses 8:91-96, 1981.
33. Ryn E, Shaey KC: Schützender Effekt von Zeolithen. Int.J. Zoonose7: 101-106, 1980.
34. Ricke SC:Das Überleben von Salmonellen im Erdreich. Bioresource Technology 53: 1-6, 1995.
35. Uchida T.: Antibakterieller Zeolith Katheter und sein Potential für den Harntrakt zur Infektionskontrolle. Hinyokike Kiyo 38.973-987, 1992.
36. Keeting PE, Oursler MJ, Wiegand KE, Boude SK, Spelsberga TC, Riggs BL: Ein Ausbreitungs-, Unterscheidungs- und Transformationswachstums-Faktor. J Bone Miner Res 7: 1281-1289, 1992.
37. Rodriguez-Fuentes G. Barrios MA, Iraizoz A Perdomo L. Cedre B (1997) Enterexantidiarrhoeprodukt, basierend auf gereinigtem natürlichem Klinoptilolith. Zeolith 19:441-448
38. Ueki A, Yamaguchi M, Ueki H, Watanabe Y, Ohsawa G, Kinugawa K, Kawakimi Y, Hyodoh F (1994) Polyclonale Aktivierung der T-Zellen durch Silicate in Vitro. Immunologie: 82:3332-335
39. Pavelic K, Colic M, (2000) Molekulare Mechanismen der Antitumorwirkung einiger diätetischer Produkte
40. Dr. Miroslav Colic, University of California, Santa Barbara und R&D Division, Molecutec Corporation, Segovia, USA